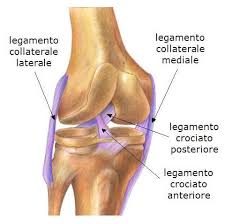
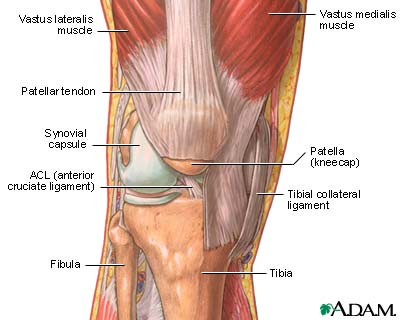
Ginocchia e rottura dei legamenti
chirurgia risolutiva per la recidiva
Articolo informativo di Giuseppe Pinna per S. O. S. - “Osteomielitici d’Italia” - Onlus «Centro Servizi Informativi On-line per Osteomielitici e Pazienti dell’Ospedale CODIVILLA-PUTTI di Cortina d’Ampezzo.
Le risposte dell'esperto alle domande dei lettori: dall'infiammazione della cartilagine alla rottura dei crociati del ginocchio, dalla frattura dell'omero all'artrosi femoro-rotulea fino ai trattamenti con le sta-minali.
Rottura del legamento
Egregio dottore, le chiedo cortesemente di spiegarmi il significato del seguente referto di RMN eseguita al ginocchio sx: "Si osserva fibrosi reattiva del corpo di Hoffa e in corrispondenza della camera anteriore con marcati artefatti ferromagnetici in corrispondenza del-la gola intercondiloidea da esiti di intervento di ricos-truzione del legamento crociato anteriore.
Regolare morfologia delle strutture ligamentose di rin-forzo capsulare.
Lesione a manico di secchia del menisco mediale con ribaltamento intercondiloideo di frammento meni-scale.
Fibrocartilagine meniscale laterale di normale morfo-logia e segnale.
In esiti di ricostruzione del legamento crociato ante-riore il neolegamento appare deflesso e discontinuo.
Utile correlazione clinica.
Apprezzabile da inserzione ad inserzione il legamen-to crociato posteriore esente da alterazioni del se-gnale.
Discreto versamento intrarticolare.
Rotula in lieve iperpressione esterna".
Risposta Sembrerebbe un caso di recidiva di rottura del legamento crociato anteriore e rottura meniscale con dislocazione di frammento.
Chirurgica la soluzione.

Infiammazione cartilaginea
Salve, ho un problema della cartilagine al ginocchio e vorrei sapere gentilmente cosa significa "pst. pulsed signal terapy". La ringrazio.
Risposta Si tratta di terapia a onde pulsanti che ha come effetto la diminuzione dell'infiammazione del tessuto cartilagineo.

Artrosi femoro-rotulea
Ho 50 anni, sono ex giocatore dilettante di basket, vorrei un consiglio per un eventuale intervento al ginocchio sinistro, affetto da seri problemi.
Ho già effettuato nel 2007 un'artroscopia in quanto il ginocchio era bloccato da problemi di menisco.
Da circa due mesi sono afflitto da dolorosissime fitte quando cammino o scendo le scale, la R. M. ha evidenziato buchi importanti nella cartilagine.
Il chirurgo che mi ha operato mi ha sconsigliato, per via dell'età, la protesi del ginocchio.
Cito di seguito la risposta del radiologo che ha effettuato gli esami richiesti dal chirurgo: "Condizione di gonartrosi bilaterale con deformazione delle spine intercondiloidee.
Artrosi femoro rotulea di grado elevato con segni di iperpressione della rotula più marcata a sinistro.
Alla valutazione del grado di flessione a 45° si osserva marcata lateralizzazione dell'asse rotuleo con in-versione dell'angolo del solco e del tilt di entrambe le articolazioni femoro rotulee.
Osteofitosi rotulea bilaterale ed osteofitosi dei profili condilari. Ridotte di ampiezza le emirime articolari femoro tibiali medialmente".
Mi hanno sottoposto a iniezioni intrarticolari di acido ialuronico, ma sinceramente non ho beneficiato di nessun giovamento.
Vorrei sapere se esistono metodi alternativi o eventuali cure per scongiurare a 50 anni questo inter-vento che poi non sarebbe risolutivo in quanto in condizioni normali di usura perderebbe di efficacia nel l'arco di 15 anni.
Risposta Se lei non ha eseguito rx delle ginocchia in carico per una valutazione dell'asse degli arti glie-lo consiglio.
Eventualmente, prima di decidere per una protesi (inadatta alla sua età), le consiglio un trattamento con cellule staminali. risposte di FERDINANDO PRIANO*

RIABILITAZIONE DEL GINOCCHIO DOPO RICOSTRUZIONE
DEL LEGAMENTO CROCIATO ANTERIORE (LCA)
PROTOCOLLI DI RIABILITAZIONE POST-CHIRURGICA
DOPO RICOSTRUZIONE CON TECNICA "TENDINE ROTULEO"
Elaborare un protocollo riabilitativo di una lesione acuta legamentosa trattata chirurgicamente
non significa formulare uno schema rigidamente standardizzato: la progressione nella rieducazio-
ne, pur attenendosi a linee guida, va adattata ai singoli casi in base alle esigenze specifiche ed
alle caratteristiche del paziente.
La riabilitazione post-operatoria cronica del LCA segue fasi temporali e dinamico funzionali ben de-
finite.
1a Fase
- prima e seconda settimana
Tutore: ginocchiera articolata bloccata a 30° 35° per 1-3 giorni, successivamente limiti fissati a 0°-90° (1asettimana)
con incrementi di 10°/settimana.
Il tutore è bloccato a 0° solo per la deambulazione ed è rimosso durante la cinesiterapia.
Carico: scarico dell'arto nei primi 4-5 giorni, quindi carico sfiorante con canadesi per 2-3 giorni, carico parziale pro-
gressivamente maggiore sino al 50% con due canadesi (fine della 2a settimana).
PROM (ROM passiva): 0°-90° alla fine della 1a settimana, 0°-110° alla fine della 2a. Se la mobilizzazione è preco-
ce e controllata, il recupero dell'articolarità passiva non è in genere difficile. La chinesiterapia passiva ed attiva as-
sistita prevede l'impiego delle metodiche FNP sin dalla 1a settimana.
AROM (ROM attiva): in tutore (e dalla 2a settimana senza) applicando gradualmente carichi fino a 4-5 kg.
Co-contrazioni multiangolari nell'arco 90°-10°.
Flessori: isometrica multi-angolare (seduto, supino, prono), FNP, leg flexion.
Quadricipite: isometrica nell'arco 110°-50° ed a 0°, estensione attiva senza pesi nel range 90°-50° (fine 2a setti-
mana), FNP sollevamento dell'arto a ginocchio stabilizzato a 30°-40° da co-contrazioni.
Anca: flessione (isometrica e con pesi prossimali al ginocchio) a ginocchio flesso (seduto, semisupino), estensione
con contemporanea estensione del ginocchio, adduzione isometrica con anca e ginocchio flessi a 45°, abduzione
(isometrica e con pesi prossimali al ginocchio) con ginocchio flesso a 30°-45°,
Collo del piede: flesso-estensione, inversione/eversione, circonduzione.
Gli esercizi vanno effettuati anche con l'arto sano per favorire la facilitazione neuromuscolare crociata (effetto "cross-
over").
Metodiche complementari: crioterapia, mobilizzazione passiva rotulea, massaggi, stretching della muscolatura del-
l'arto inferiore (da proseguire per tutta la durata della riabilitazione), elettrostimolazioni contemporanee di quadrici-
pite ed ischiocrurali a ginocchio flesso.
2a Fase
- terza settimana
Tutore: 0°- libero
Carico: parziale 50% con una canadese
PROM: 0°-120°.
AROM: continuare gli esercizi isometrici e contro resistenza (aumentando progressivamente i carichi sino a 8-9 kg)
e le tecniche FNP enfatizzando l'attività eccentrica.
Inoltre: isometrica multiangolare per quadricipite ed estensione attiva senza pesi (in entrambi i casi limitando l'es-
tensione a 300).
- Cyclette
- Inizia il programma in piscina: schemi di passo, esercizi di articolarità.
- quarta e quinta settimana
Tutore: abbandono in casa e di notte (4a settimana) e poi definitivamente (fine 5a settimana).
Carico: totale senza stampelle (4a settimana).
- Inizia il programma di nuoto: dorso, stile libero (anche con ausilio di pinne).
- Intensificare il programma di potenziamento integrandolo con: estensione attiva nell'arco 90°-0° (senza pesi),
leg extension (con pesi) con escursione progressiva 90°-0° (dalla 5a settimana); potenziamento del tricipite sura-
le con sollevamenti sulle punte (seduto, in piedi) in appoggio bi e monopodalico, anche con pesi in mano; co-con
trazioni nell'arco terminale di estensione sotto carico (lateral step up); leg press 90°-20° (isometrica, isotonica, an-
che monopodalica); semi-squat 90°-30° in appoggio bi/monopodalico con tronco inclinato in avanti a oltre 30°, con
progressivo guadagno dell'estensione completa entro l'8a settimana; esercizi di extra/intrarotazione tibiale con re-
sistenza elastica (tubing).
- Inizia il potenziamento eccentrico contro resistenza dei muscoli ischiocrurali; aumentano i carichi del loro poten-
ziamento concentrico.
- Potenziamento isocinetico (dalla 5a settimana) 90°-20° inizialmente sottomassimale a medie-alte velocità, con
graduale progressione dell'intensità e del volume di lavoro.
- Rieducazione propriocettiva: recupero degli schemi del passo (anche con metodiche assistite); bilanciamento
monopodalico al suolo con/senza supporto (anche visivo); esercizi con tavoletta instabile in appoggio bi/monopoda-
- Proseguono gli esercizi di potenziamento aumentando progressivamente
intensità e numero di ripetizioni. Semi-squat 90°-0°.
intensità e numero di ripetizioni. Semi-squat 90°-0°.
- Leg press monopodalica 90°-0° con progressione verso l'estensione totale.
- Isocinetica massimale ad alte velocità.
- Rieducazione propriocettiva.
- Inizia il potenziamento eccentrico del quadricipite.
- Bicicletta su strada.
- Tapis roulant.
- Programma di corsa simulata in acqua.
*ottava-dodicesima settimana
Continuano il potenziamento e la rieducazione propriocettiva.
Quando il paziente ha recuperato nell'arto infortunato almeno l'80-85% della
forza di flessori e quadricipite rispetto all'arto sano, può iniziare il programma
di corsa sul campo, su superficie morbida elastica (erba, terra, pista), indos-sando il tutore funzionale, inizialmente in piano ed in linea retta, con progres-
sivo incremento delle distanze percorse e della velocità, in avanti ed all'indie-
tro. Quando il soggetto è in grado di correre per 4-5 km senza disturbi si aggiungono esercizi di agilità:
- Corsa sul posto a ginocchia alte.
- Corsa in cerchio.
- Percorso di slalom.
- Corsa descrivendo figure ad «8» progressivamente più piccole, a velocità sempre maggiori.
- Corsa a zig-zag.
- Corsa laterale.
- Partenze sprint/arrivi in lenta decelerazione e viceversa.
- Corsa con cambi di direzione omolaterali ed incrociati rispetto all'arto infortunato, inizialmente dolci e graduali fino
ad arrivare a scartare di 90° alla massima velocità.
ad arrivare a scartare di 90° alla massima velocità.
- Sprint con cambi di direzione a comando.
Una volta conseguite buone capacità di controllo nelle precedenti attività, si completa la riabilitazione con esercizi
bi/monopodalici di salto e di pliometria:
bi/monopodalici di salto e di pliometria:
- Saltelli.
- Trampolino elastico.
- Salti sul posto ed avanti/indietro/di lato.
- Salto della corda.
- Scale in salita.
- Percorsi in slalom ed a zig-zag.
- Corsa e salti laterali resistiti da corda elastica.
- Salti al termine di brevi sprint previa decelerazione a differenti velocità.
- Salti da sgabelli di diversa altezza, progressivamente integrati da veloci scarti di direzione dopo l'atterraggio.
Nella parte finale del programma di riabilitazione si introducono gradualmente gli esercizi tecnici specifici dello sport
praticato dall'atleta.
praticato dall'atleta.
Il ritorno alla piena attività è permesso quando siano soddisfatte le seguenti valutazioni cliniche e funzionali:
- Assenza di versamento e dolore durante/dopo sforzo.
- Articolarità passiva ed attiva completa.
- Problemi femoro-rotulei assenti o modesti, ma compensati con buona funzionalità del muscolo vasto media-le obliquo.
- KT 1000: differenza di traslazione tibiale anteriore con l'arto controlaterale non superiore a 3-5 mm, com-pliance index uguale bilateralmente.
- Test isocinetici: picco di forza e lavoro totale dei flessori bilateralmente uguali in almeno due test su tre a ve-locità angolari diverse (eventualmente mirando a conseguire nell'arto infortunato, rispetto al controlaterale,un incremento dell'1% dei valori di picco di forza e lavoro totale dei flessori per ogni mm di traslazione tibialeanteriore in eccesso); rapporto flessori/estensori uguale bilateralmente in almeno due test su tre a velocitàangolari differenti; deficit del picco di forza del quadricipite non superiore al 10% rispetto all'arto sano, in al-meno due test su tre a diverse velocità angolari.
- Test funzionali di stabilità dinamica e di agilità (anche sport specifici) con differenze contenute rispetto alloarto sano.
È infine fondamentale, per conservare gli adattamenti recuperati e sviluppati, impostare un programma di mante-
nimento bi/trisettimanale, affiancato ad una periodica valutazione che preveda: esercizi di potenziamento della
muscolatura degli arti inferiori a catena cinetica aperta e chiusa opportunamente integrati, ginnastica propriocettiva,
stretching.
PROTOCOLLI DI RIABILITAZIONE POST-CHIRURGICA
DEL LCA DOPO RICOSTRUZIONE
- 24 ore dopo l'intervento
- ROM del tutore: 10°- 90°
- ROM del CPM: 10°- 50°/60°
- movimenti del collo del piede
- contrazioni isometriche del quadricipite sul CPM (come nel tendine rotuleo)
- Dalla 2a alla 4a giornata
- ROM del CPM: FLEX 60° - 90°; EXT 10°
- tutto il resto come per il tendine rotuleo
- Dalla 6a alla 14a giornata
- ROM del CPM: FLEX 90° - 110°; EXT 10° - 0°
- vietate le co-contrazioni flessori-quadricipite e gli esercizi di flessione attiva
- tutto il resto come per il tendine rotuleo
- Dalla 15° giornata all'ottavo mese
- nessuna variazione rispetto al programma indicato per il tendine rotuleo
DEL LCA DOPO RICOSTRUZIONE
- 24 ore dopo l'intervento
- tutto come per il tendine rotuleo
- Dalla 2a alla 5a giornata
- tutto come per il tendine rotuleo
- Dalla 6a alla 14a giornata
- vietati le co-contrazioni flessori-quadricipite e gli esercizi di flessione cinetica attiva
- tutto il resto come per il tendine rotuleo
- Dalla 15a giornata all'ottavo mese
- nessuna variazione rispetto al programma indicato per il tendine rotuleo
Rottura del legamento crociato anteriore Immagine rottura dellegamento crociato anteriore IL RUOLO DELLA RMN NEL TRATTAMENTO CON ACI
DELLE LESIONI DELLA CARTILAGINE ARTICOLARE
Introduzione
Già nel 1743 Hunter scriveva "Da Ippocrate ai tempi nostri la cartilagine ulcerata è un disturbo fastidioso e
una volta instaurata non si ripara" e Sir James Paget nel 1853 affermava "Io credo che non esistono casi
nei quali la perdita di porzione della cartilagine è stata restaurata con nuova e ben formata cartilagine perma-
nente"; da allora vari AA. (Magnusson 1941, Pridie 1959, Insall 1967, Johnson 1986) hanno cercato di af-
frontare questo problema riuscendo solo in parte a migliorarlo.
Si deve all'artroscopia se oggi le lesioni della cartilagine articolare sono ben conosciute.
Di fronte ad un trauma contusivo, in passato, nessun chirurgo si sarebbe sognato di praticare un'artrotomia
per verificarne il danno biologico.
L'artroscopia, imponendosi come tecnica atraumatica, ha permesso di migliorare la conoscenza delle lesioni
traumatiche della cartilagine articolare e nello stesso tempo di approfondire quella delle lesioni degenerative
(1,2).
Frequenza
Le lesioni della cartilagine articolare sono molto frequenti.
In un nostro precedente lavoro nel quale abbiamo esaminato una serie di 4.463 artroscopie, abbiamo riscon-
trato 4.620 lesioni della cartilagine articolare.
Complessivamente 1.851 lesioni della femoro-rotulea, 1.777 lesioni del compartimento mediale e 992 lesioni
del compartimento laterale.
I casi che non presentavano lesioni della cartilagine articolare erano 362 pari solo all'8,1%.
Complessivamente le lesioni a tutto spessore erano 552 (11,9%).
Esse riconoscono una etiopatogenesi quanto mai varia.
Terapia
Nelle lesioni ulcerative della cartilagine articolare il debridement è insufficiente ed attualmente la terapia chi-
rurgica di queste lesioni si basa su due concetti fondamentali:
1 - Stimolazione della crescita fibrocartilaginea con:
Perforazioni (Pridie 1957)
Spongiosizzazione (Ficat 1979)
Abrasione (Johnson 1986)
Microfratture (Steadman 1992)
2 - Innesti con:
Innesti pericondrali (Skoog 1976, Homminga 1990)
Allotrapianti (Mcdermott 1985, Convery 1991)
Innesti periostali (O'Driscoll 1986)
Innesti osteocondrali autologhi (Hangody 1994, 1996)
Reimpianto di condrociti autologhi (Brittberg 1994, Peterson 1997)
Re-impianto di condrociti autologhi (A.C.I.)
Di fronte ai risultati non entusiasmanti delle varie tecniche chirurgiche, Peterson nel 1987 ha ideato il reim-
pianto dei condrociti autologhi.
(3) L'impiego delle colture di condrociti permetterebbe la completa reintegrazione delle superfici articolari
anche nelle lesioni di ampie dimensioni.
(4) La prima tecnica impiegata è stata la tecnica Carticel che consiste nel prelevare in artroscopia una pic-
cola quantità di tessuto cartilagineo di 5x10 mm dalla gola intercondilica dell'articolazione danneggiata.
(5) Successivamente in laboratorio, si esegue la frammentazione e la digestione enzimatica della cartilagine
per isolare i condrociti che vengono sottoposti ad espansione in vitro fino ad arrivare a 12 milioni di cellule
in un periodo di 2-3 settimane.
Nella fase di impianto (Fig. 1), eseguito dopo almeno 5 settimane, tramite un'artrotomia, viene preparato il
fondo del difetto; occorre rimuovere con curette tutta la cartilagine articolare fissurata e sottominata circos-
tante la lesione condrale fino ad arrivare all'osso subcondrale; mediante bisturi del 15 vengono eseguiti bor-
di netti incidendo la cartilagine articolare verticalmente verso il piano osseo subcondrale senza penetrare nel-
l'osso stesso.
Una volta preparato, il fondo del difetto viene misurato oppure sagomato mediante foglio lucido sterile.
Un lembo periostale (Fig. 2) di 2 cm maggiore rispetto al difetto viene prelevato dalla tibia prossimale media
le, distalmente all'inserzione della zampa d'oca, utilizzando un bisturi del 15 e un piccolo scollaperiostio retto.
Il periostio viene posto a coprire il difetto con lo strato cambiale rivolto verso il basso e viene suturato me-
diante punti staccati di Vycril 6.0 (Fig. 3) con ago tagliente lasciando una apertura superiore per la succes-
siva introduzione dei condrociti; i nodi vengono posti dal lato del periostio cosi che rimangono sotto la carti-
lagine adiacente.
Per migliorare la tenuta del lembo viene applicata colla di fibrina (Fig. 4).
Successivamente la sospensione di condrociti viene iniettata all'interno attraverso l'apertura superiore verso
il basso fino a riempire il difetto utilizzando una apposita siringa con ago calibro 18 o superiore (Fig. 5).
Altre tecniche hanno la caratteristica di veicolare i condrociti su supporti biologici (FAB - Verigen). (Fig. 6).
Ruolo della RMN
La necessità della valutazione dell'evoluzione del reimpianto ha trovato nella RMN un valido ausilio.
Non essendo infatti un esame dannoso per il paziente in quanto non vengono emesse radiazioni ed essendo
non invasivo rappresenta sicuramente l'esame diagnostico di prima scelta.
A queste fondamentali caratteristiche si deve aggiungere l'alta accuratezza posseduta dalla RMN per lo stu-
dio morfologico della cartilagine articolare.
Negli ultimi periodi si sono sviluppate tecniche diagnostiche sempre più sofisticate per cercare di dare rispos
te il più convincenti possibili sull'evoluzione del trattamento chirurgico.
L'ICRS ha stabilito un protocollo per la valutazione tramite RMN del trattamento con ACI.
Tale protocollo prevede diverse acquisizioni tramite l'uso di 5 diverse tecniche di RMN (Fast spin echo, Pro
ton-density-weighted FSE senza soppressione del grasso, FSE-T2 pesata, FSE-T1 pesata, gradient-echo
con eccitazione dell'acqua). (6).
Attualmente è possibile ottenere informazioni sulla composizione biochimica della cartilagine e sulle proprie-
tà funzionali delle articolazioni.
Deborah Burstein e Martha Gray hanno analizzato la cartilagine articolare con una tecnica denominata
dGEMRIC (delayd gadolinium enhanced MRI of cartilage).
Questa tecnica sfrutta la capacità del gadolinio (Gd-DPTA) di distribuirsi laddove vi siano delle cariche nega
tive, essendo esso stesso dotato di carica negativa.
I glucosaminoglicani presenti nella cartilagine articolare normale posseggono abbondanti cariche negative e
quindi il mezzo di contrasto si legherà ad essi, permettendo cosi la quantificazione della concentrazione dei
GAG e una più precisa analisi della percentuale di cartilagine normale presente. (7).
Sebbene sia indubbia l'utilità della RMN nel programma di follw-up dei pazienti, alcune perplessità nascono
dall'interpretazione dei risultati e dalla mancanza di unanimità fra i vari autori circa la standardizzazione della
procedura diagnostica e su quali tipi di sequenze usare.
Sally Roberts ha analizzato i risultati dopo ACI tramite 3 tipi diversi di acquisizione:
T1 spin echo sagittali e coronali per ricavare informazioni generali sull'anatomia articolare e per definire even-
tuali danni meniscali o ligamentosi.
Immagini 3D T1 pesate in modo da ricavare informazioni sulla qualità e lo spessore della cartilagine.
Immagini 3D con soppressione del grasso per studiare la superficie cartilaginea ed eventualmente identifica-
re versamenti intraarticolari e la presenza di edema nell'osso subcondrale. (8).
Quando eseguire il primo controllo post-operatorio?
I vari lavori non danno una risposta univoca e forse contribuiscono a generare confusione.
Certamente i controlli vanno eseguiti rispettando i tempi di attecchimento del trapianto e la biologia della for-
mazione del collagene.
Recht e coll. hanno osservato che nei periodi immediatamente susseguenti il trapianto si assiste ad un aumen-
to del numero di condrociti e alla formazione di un tessuto di riparazione primitivo, di consistenza soffice.
Questo primo stadio intercorre nelle prime 6 settimane.
Anche la RMN rivelerà questi cambiamenti, dando un segnale eterogeneo ma al contempo ipointenso nelle
sequenze T2 pesate.
Usando il mezzo di contrasto si nota un maggior aumento di contrasto nel tessuto di riparazione durante i pri-
mi 3 mesi rispetto alle immagini acquisite a 1 anno.
Questi mutamenti sono dovuti all'aumento dei GAG nella matrice extracellulare che si va formando man ma-
no che maturano gli ACI.
Perchè avvenga il totale riempimento del difetto osteocondrale è necessario 1 anno.
Il segnale in RMN appare ancora eterogeneo e ipointenso e il segnale di un'avvenuta integrazione degli ACI
è dato dalla presenza di una banda scura.
Talvolta si può reperire un segnale simil-fluido, mimante una fissurazione. La spiegazione è dovuta al fatto che
può non esserci stata una copertura totale del periostio, ma al controllo artroscopico si osserva la perfetta in-
tegrazone del trapianto.
Brittberg concorda sul fatto che il primo controllo con RMN sia utile eseguirlo non prima di 1 mese, a causa
della possibilità di distorsione dell'esame dovuta alla presenza di un segnale simil edematoso nel midollo sot-
tostante la cartilagine.(6).
protesi del legamento del ginocchio (legamento crociato)
Henderson ha eseguito uno studio su 57 pazienti, valutandoli clinicamente e con RMN a 3 e 12 mesi.
Egli ha notato le lesioni apparire normali o quasi normali nel 41% dei casi a 3 mesi di distanza.
A 1 anno dal trattamento ci fu un incremento nel punteggio RMN con una normalità del processo riparativo
nell'81,6% dei casi. (9).
Alcuni autori hanno altresì proposto l'uso di una combinazione meccano - acustica per lo studio cartilagineo
ottenendo risultati incoraggianti.
La tecnica è stata proposta da Laasanen.
Egli ha analizzato tramite esame ultrasonografico e meccanico le caratteristiche della degenerazione cartilagi-
nea e del trapianto di condrociti in modelli di bovino e di porcellini. (10).
Quante RMN eseguire?
Anche qui il quesito rimane forse senza risposta.
Stando a quanto riportato dagli autori, sembrerebbe giustificata una prima RMN ad 1 mese dall'intervento.
Una seconda può essere giustificata a 6 mesi, per poter eventualmente diagnosticare fallimenti del trapianto.
A 12 mesi rimane sicuramente obbligatoria una terza RMN, abbinando anche il controllo clinico così come
raccomandato dall'ICRS.
Tale è infatti il tempo necessario affinché il difetto cartilagineo venga totalmente rimpiazzato e riempito dal neo-
tessuto.
Istologia
La cartilagine articolare è una cartilagine di tipo jalino, costituita da condrociti immersi in una matrice extracel-
lulare ricca di proteoglicani e GAG.
Questi ultimi sono legati ad una rete di collageno di tipo II.
La ultrastruttura cartilaginea si compone di 4 strati la cui transizione avviene in maniera graduale.
Gli strati sono, dal più superficiale al più profondo, zona I (superficiale o tangenziale), zona II (intermedia o di
transizione), zona III (profonda o radiale) zona IV (tessuto calcificato).
Negli strati superficiali e intermedi il collagene maggiormente rappresentato è di tipo II, un tipo di collagene
presente in pochi altri tessuti.
Questo tipo di collagene rappresenta il 95% circa della composizione collagenica della cartilagine articolare.
Altri tipi di collagene che vengono reperiti sono il IX, X, XI e VI.
Il X, in particolare lo si ritrova in special modo negli strati più profondi.
L'equilibrio della cartilagine è garantito dalla intensa attività di enzimi degradativi (MMP-1, MMP-2, MMP-3)
e citochine (il-1, TNF alfa, TGF beta, IFN gamma, IGF-1).
Gli studi istologici classici forniscono indubbiamente ottimi risultati sulla reale natura del neo-tessuto.
Tuttavia oggi le indagini ultrastrutturali si sono evolute ed ora è possibile avere più notizie anche grazie alla
ricerca dei markers biochimici nel liquido articolare, che ci può far valutare il processo riparativo e il turno-
ver della cartilagine articolare. (11).
Numerosi studi hanno dimostrato come il sito sede di lesione venga ottimamente riparato mediante la tecni-
ca ACI.
ESPLOSIONE DELLE CARTILAGINI E ROTTURA
E' ormai ampiamente dimostrato come il tessuto cartilagineo riparativo possegga, in molti casi, le caratteristi-
che istologiche della cartilagine normale.
In uno studio su 14 pazienti trattati con ACI, Briggs e coll. hanno eseguito un'analisi istologica della neo
cartilagine.
In 6 pazienti fu trovata la presenza di sola cartilagine jalina, in 2 pz. coesistevano cartilagine jalina e fibro-
cartilagine (tessuto misto), in 4 pz. era rappresentata solo la fibrocartilagine e in altri 2 pazienti vi era la pre-
senza di solo tessuto fibroso.
Gli 8 pazienti che presentavano un tessuto riparativo simil-jalino possedevano le caratteristiche istologiche
della cartilagine jalina normale.
In essi fu infatti ritrovato collagene di tipo X nello strato più profondo; in tutti questi pazienti il collagene di
tipo II era normalmente rappresentato negli strati medi.
Anche nei 3 pazienti che possedevano tessuto misto fu rinvenuto collagene di tipo II negli strati medi. (12).
In uno studio su 20 pazienti trattati con ACI, Roberts e coll. hanno sottoposto ad analisi istologica ed immu-
noistochimica la neo cartilagine.
E' stato osservato come il 90% del tessuto formatosi fosse rappresentato da cartilagine jalina in 5 prelievi
bioptici, da fibrocartilagine in 7 e da cartilagine "mista" (jalina-fibro) in 11.
L'analisi immunoistochimica ha inoltre dimostrato una reazione positiva per il collagene di tipo II in tutti i
prelievi istologici costituiti da cartilagine jalina.
La colorazione specifica per il collagene X ha dato esito positivo nel 62% dei casi.
Questo collagene si ritrovava in piccole aree, vicino alla cartilagine calcificata, all'osso o alla regione denomi-
nata "tidemark".
Fra i proteoglicani, ben rappresentato era il condroitin-4-solfato, seguito dall'epitopo del cheratan solfato.
Nel tipo II e IV di collagene venne ritrovato l'epitopo del condroitin-6-solfato.
Questa analisi immunoistochimica dimostra la alta similitudine fra la cartilagine jalina originale e quella ottenuta
tramite ACI. (8).
Esplosione dei suoi menischi e legamenti
Numerosi altri studi sono stati fatti nel tentativo sempre più pressante di capire se le caratteristiche non solo
morfologiche, ma anche biochimiche, della cartilagine trapiantata potessero essere assimilabili a quella della
cartilagine normale.
Tra questi un interessante studio di Schneider che ha analizzato l'attività del processo riparativo cartilagineo
tramite l'analisi dei markers molecolari (MMP-1, MMP-2, MMP-3, TImp e PICP) in una casistica di 17 pa-
zienti (età media 34 anni) sottoposti ad ACI.
In tutti i pazienti l'attività dei markers molecolari rifletteva quella di una normale cartilagine.
Purtroppo però, nonostante l'entusiasmo iniziale, bisogna ribadire che i markers analizzati non sono espressa-
mente specifici per la cartilagine, ma possono ritrovarsi in numerosi altri tessuti.
Ulteriore problema è rappresentato dall'influenza sulla concentrazione di tali markers dalla eventuale presen-
za di sinovite o di effusione edematosa. (13).
Appare perciò chiaro che a disposizione dei chirurghi non vi è il solo controllo istologico dell'area trapiantata.
Allo stato attuale la moderna medicina offre numerose altre possibilità di controllo dei risultati.
Come si è infatti visto accanto alla tradizionale analisi istologica, si affiancano tecniche sempre più raffinate
quali l'immunoistochimica, la biologia molecolare nel tentativo sempre più pressante di riuscire ad ottenere
i migliori risultati possibili.
Appare altresì chiaro come il neo tessuto sia molto simile alla cartilagine articolare normale, ma non totalmen
te uguale.
Cartilagine e menischi del ginocchio. I legamenti sono quattro
Infatti le caratteristiche istologiche e biochimiche degli ACI sono quelle di un tessuto simil-jalino, con una
composizione di collagene simile ma non del tutto sovrapponibile a quella della normale cartilagine.
Risultati
Sono riportati buoni risultati sia temporanei che a distanza.
Brittberg (5) ha riportato i risultati di 23 pazienti trattati con ACI, 16 erano localizzati al condilo femorale
mediale e 7 alla rotula.
A 39 mesi di follow-up i risultati eccellenti o buoni erano presenti nell'87 % dei pazienti con localizzazione
femorale, e solo nel 28,5% con localizzazione rotulea.
Minas (6) ha riportato risultati soddisfacenti in oltre l'80 % dei casi nelle lesioni a tutto spessore di dimen-
sioni 2 cm associati a lesioni del LCA.
Su 59 pazienti con lesioni dei condili femorali (24 isolate di dimensioni 4 cm q, e 16 con lesione del LCA di
dimensioni 3.4 cm q, e 19 con OD di dimensioni 5.3 cm q e profondità 10 mm), ad un follow-up di 2-9 anni,
l'85% dei pazienti ha ottenuto risultati buoni ed eccellenti, il 92 % delle lesioni isolate, il 75% del gruppo del
LCA ed l'89% delle OD.
Inoltre dagli studi sui cani è stato riscontrato che dopo innesti osteocondrali, la cartilagine dell'innesto mantie-
ne la sua caratteristica mentre lo spazio tra l'innesto e la cartilagine articolare viene riempito con fibrocartilagine.
Mentre con la tecnica di reimpianto di condrociti si otterrebbe una completa reintegrazione delle superficie arti-
colari.
protesi del legamento del ginocchio
Indicazioni e criteri di esclusione
Di fronte ad un paziente con difetto cartilagineo, le indicazioni al trattamento chirurgico con ACI devono ba-
sarsi sull'anamnesi, sull'esame obiettivo e sull'esame radiografico che deve comprendere le proiezioni standard
eseguite in ortostatismo, l'assiale della rotula a 45° e la proiezione di Rosenberg.
Le indicazioni principali al trattamento chirurgico con ACI sono costituite da:
-sintomatologia caratterizzata da:
dolore acuto localizzato sulla rima articolare
blocchi
versamenti
-fallimento del trattamento fisiokinesiterapico o conservativo
-allineamento normale o quasi normale
-quadro di degenerazione artrosica di grado lieve o medio.
Sono esclusi i pazienti affetti da:
sovrappeso
rigidità articolare
deviazioni assiali di 5°
malattie infiammmatorie e artrite reumatoide
artrosi severa
età relativa al caso clinico.
E' comunque opinione comune che un'attenta selezione dei pazienti minimizzi il rischio di insorgenza di com-
plicanze.
RIABILITAZIONE DELGINOCCHIO
Vivamente sconsigliati sono infatti gli ACI in quei pazienti che abbiano una storia di artrosi avanzata e in quei
pazienti in cui sia reperita la cosiddetta "kissing lesion". (3).
Controindicazione agli ACI viene altresì costituita dalla concomitante presenza di una pregressa meniscecto-
mia, di instabilità ligamentosa o di un malallineamento osseo.
Vivamente sconsigliata è pure l'abitudine al fumo.
E' infatti ormai noto che il fumo, fra i vari effetti deleteri, abbia anche la capacità di interferire con il processo
riparativo delle fratture e con la crescita dei condrociti.
Si deve perciò far smettere di fumare il paziente che debba essere sottoposto ad ACI se si vuol conseguire
un buon risultato.
All'interno del ginocchio c'è un liquido chiamato sinovia
Mont e coll. hanno analizzato l'appropiatezza dell'indicazione al trapianto di condrociti in 24 pazienti.
La tecnica scelta era il Genzyme (carticel).
Ebbene il risultato fu abbastanza sorprendente.
Nel 96% dei pazienti non vi era indicazione al Genzyme.
In 23 pazienti furono riconosciute delle condizioni patologiche o anagrafiche che avrebbero dovuto sconsi-
gliare l'impiego del trapianto di condrociti autologhi.
Fra le patologie presenti vi erano anche l'algodistrofia simpatico riflessa, lesioni più grandi di 10 cm 2, pic-
cole lesioni multiple e lesioni rotulee. (14).
Controverso rimane il trattamento dell'osteocondrite dissecante.
legamento crociato anteriore (LCA)
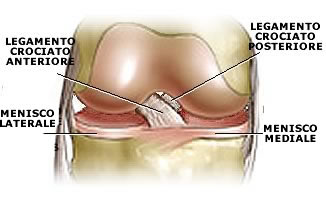
La tendenza generale è comunque quella di un trattamento conservativo nei pazienti di età adolescenziale op-
pure in quei casi nei quali il frammento distaccatosi presenti caratteristiche di stabilità.
L'opzione chirurgica è riservata generalmente a pazienti in età adulta o quando siano presenti segni clinici ri-
levanti, quali per esempio dolore intenso. (15).
Altri studi sono stati eseguiti per stabilire quando sia il caso di intervenire chirurgicamente e quando invece sia
necessario trattare il paziente con terapie fisiche e riabilitative.
In questo senso sembra essere molto utile l'indagine tramite RMN.
Infatti questo esame diagnostico, fornendo un'analisi morfologica della lesione, può aiutare il chirurgo nella
miglior scelta terapeutica.(16).
Numerose tecniche chirurgiche sono state proposte per l'OCD.
Vi sono il semplice debridement artroscopico, la fissazione, il trapianto osteocondrale e gli ACI.
Recentemente l'ICRS ha riclassificato l'OCD, in base alla stabilità o meno del corpo libero e in base alla gran
dezza del frammento distaccatosi.
Questo nel tentativo di precisare meglio la morfologia della lesione, per eliminare quelle discrepanze interpre-
tative riguardo le patologie a carico della cartilagine articolare e, non ultimo, per porre delle corrette indica-
zioni terapeutiche. (17).
Peterson ha trattato 18 pazienti sofferenti di OCD con tecnica ACI.
La percentuale di successo riportata è stata dell'9% (16 pz su 18). (3).
Lo stesso Peterson ha successivamente trattato 58 pz. affetti da OCD, ottenendo risultati lusinghieri in più del
90% dei pazienti. (18).
Anche le fratture del piatto tibiale costituiscono una sfida per chi voglia tentare di riparare al danno cartilagineo
conseguente.
In questo caso, trattandosi di zone di carico, gli ACI sono nettamente controindicati.
Shasha e coll., in uno studio di coorte, hanno analizzato a 12 anni di distanza 65 pazienti con frattura di piatto
tibiale, trattati con il trapianto osteocondrale, riportando un discreto successo in 44 pazienti. (19).
Complicanze
In uno studio retrospettivo da 2 a 9 anni, Lars Peterson ha riportato 52 eventi avversi in 101 pazienti trattati
con ACI.
Egli ha osservato 3 casi di infezione superficiale della ferita chirurgica, per altro rispondenti alla terapia antibio-
tica e la comparsa di febbre (senza dati di laboratorio positivi) in un paziente.
In due casi la comparsa di ematoma.
In un caso di questi si ebbe anche la presenza di emartro.
Dieci pazienti lamentarono la presenza di aderenze post-operatorie, con conseguente rigidità e ipertrofia sino-
viale.
Fu pertanto necessario un secondo intervento di lisi aderenziale con miglioramento del quadro clinico.
L'ipertrofia periostale fu invece osservata in 26 pazienti.
Solo in sette però fu sintomatica.
Negli altri casi fu un reperto artroscopico.
Nei casi sintomatici fu praticata una escissione artroscopica dell'esuberanza periostale con ottimi risultati.
In sette pazienti ci fu il fallimento dell'impianto.
Peterson osservò che il fallimento avvenne entro i primi due anni dall'intervento. (3).
Un caso singolare viene riportato da Marlovits e coll.
Questi autori riportano l'insorgenza della borelliosi di Lyme in un paziente trattato con ACI.
Questo paziente aveva manifestato 15 anni prima una reazione eritematosa conseguente a morso di zecca.
La Borrelia burgdoferi fu ritrovata nel liquido sinoviale.
Questi autori pongono quindi l'accento sull'importanza dell'analisi del liquido sinoviale per evitare il rischio di
risvegliare batteri dormienti ed evitare perciò serie complicanze post-operatorie. (20).
Le complicanze più frequenti ad ogni modo rimangono l'ipertrofia periostale, l'incompleta copertura del difet-
to cartilagineo e il completo distacco del trapianto, processo che prende anche il nome di delaminazione.
Recht e coll. hanno ben descritto tramite esame RMN tutte le succitate complicanze.
Hanno trovato che nel 26% dei pazienti trattati con ACI si era sviluppata un'ipertrofia periostale, la quale pe-
rò aveva avuto un decorso silente nella maggior parte dei pazienti.
Altrettanto asintomatica è risultata essere l'incompleta riparazione del difetto cartilagineo, evenienza comunque
rara.
Nel 5% dei casi osservati invece, si è verificata la delaminazione.
I pazienti accusavano rapido insorgere del dolore, sensazione di blocco articolare e sensazione di scricchiolio.
Questo evento si verifica entro i primi 6 mesi post-operatori.
La RMN è in questo caso molto sensibile e specifica, anche se risulta difficile differenziarla da una ipertrofia
periostale, un'altra complicanza degli ACI. (21).
Discussione
Alcuni fattori rivestono notevole importanza e condizionano il risultato del trattamento chirurgico:
L'età dei pazienti e risultati.
Il paziente ideale per il trattamento con ACI è un paziente di età giovane, nel quale i risultati raggiunti sono si-
curamente migliori di quelli che si avrebbero applicando la tecnica ACI in pazienti più anziani.
Altra caratteristica fondamentale è che la lesione condrale deve essere singola e possibilmente non associata
ad altre lesioni a carico del ginocchio.
Eventuali danni a carico di legamenti o rotula andrebbero trattati preventivamente e non in concomitanza degli
ACI.
Peterson ha presentato una casistica di 101 pazienti trattati con tecnica ACI.
Di questi 101 pazienti 94 hanno seguito un programma di follow-up da 2 a 9 anni.
I pazienti furono suddivisi in 5 gruppi, in base alla presenza di patologie concomitanti (ricostruzione di LCA,
OCD) oppure no (lesione femorale singola o multipla).
L'età media dei pz era di 32.2+/- 1.8 (17- 48).
In tutti i gruppi fu notato un netto miglioramento e della sintomatologia e della qualità del neo tessuto cartila-
gineo, valutato secondo il Brittberg scoring system.
Nel gruppo trattato solo per lesione singola (I gruppo) l'età media era di 32,2 anni.
Questo gruppo ebbe i risultati migliori, facendo registrare un miglioramento nel 92% dei pz.
Risultati peggiori si ebbero nei gruppi nei quali venne associato al trattamento con ACI anche una procedura
ricostruttiva (ricostruzione LCA e riallineamento rotuleo).
In questi gruppi (IV e V) il miglioramento fu osservato solo nel 68% dei pz, pur essendo di età media inferio-
re (26,9 nel IV e 27,2 nel V) al I gruppo.
Osteofiti nell'artrosi del ginocchio
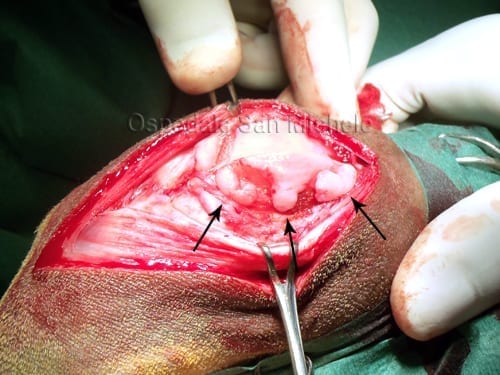
Il peggior risultato fu ottenuto nel gruppo che presentava lesione osteocondrali multiple (Gruppo II), con un
miglioramento nel 67% dei casi.
Questi pz avevano un'età media di 35,6 anni. (3).
In un altro studio Henderson ha analizzato 57 pazienti (45 M e 12 F) con età media di 40.5 anni (21 - 64).
Le ginocchia operate furono 58 e solo 19 di queste non avevano mai subito un intervento chirurgico; 38 gi-
nocchia invece risultavano essere state operate prima del trapianto di condrociti o in concomitanza di esso.
Fra gli interventi chirurgici eseguiti vi erano 5 ricostruzioni di LCA, 7 microfratture, 17 meniscectomie mediali
e 12 laterali, 17 debridment.
2 pazienti erano stati trattati con osteotomia tibiale alta, 2 pazienti avevano subito un release dell'alare
esterno e 3 un intervento al tendine rotuleo.
Presentavano una singola lesione femorale 38 ginocchia, mentre nelle rimanenti ginocchia erano presenti
più lesioni.
I risultati ottenuti in tutti i pazienti, dimostravano un miglioramento nell'81% delle 58 ginocchia operate.
A 12 mesi dall'intervento il punteggio IKDC era migliorato nel 87,9% delle ginocchia.
Questo studio però non suddivide i pazienti per età a seconda delle lesioni.
Risulta perciò difficile stabilire dei risultati attendibili per età. (9).
Briggs e coll. hanno valutato 14 pz. dopo trapianto di ACI.
L'età media era di 30 anni (16 - 51).
Tutti e 14 i pz avevano subito almeno un intervento chirurgico in precedenza, fra i quali ricostruzione di LCA
(4), rimozione di corpi mobili (1), pulizia artroscopica (11), debridement meniscale artroscopico (4), pulizie
multiple (5).
Sette pazienti avevano subito più di un intervento chirurgico.
Miglioramenti erano stati osservati nel 57% dei pazienti (11 su 14) a un anno dall'intervento. (12).
Grigolo e coll. hanno confrontato due differenti tecniche ACI, quella secondo Brittberg-Peterson (con
flap periostale) e quella con FAB (Hyaff-11).
Furono selezionati 30 pz di età compresa fra i 18 e 55 anni.
In entrambi i gruppi furono notati miglioramenti con le schede di valutazione di Lysholm-Tegner e Cincin-
nati. L'esame RMN eseguito a 6 mesi di distanza dall'intervento dimostrava la formazione di tessuto cartila-
gineo simil-jalino.
Rottura dei legamenti crociati
Dopo1 anno venne eseguito un esame istologico.
Fu possibile notare la presenza di collagene di tipo II in entrambi i gruppi e la fromazione ormai completa di
cartilagine di tipo simil-jalina. (22).
Cherubino e coll. hanno trattato 13 pazienti affetti da lesioni osteocondrali con la tecnica MACI (Verigen,
Leverkusen).
Nello studio furono arruolati 9 maschi e 4 femmine.
L'età media era di 35 anni, con un range da 18 a 49.
La pz più giovane presentava un'osteocondrite dissecante localizzata al condilo femorale mediale, il più vec-
chio soffriva di una lesione traumatica a carico della troclea femorale dx.
Complessivamente 6 pz. (3 M e 3F) presentavano un'osteocondrite dissecante.
6 pz (5 M e 1 F) avevano subito una lesione traumatica a carico del condilo femorale (3 pz), della troclea
femorale (1 pz), della cupola astragalica (1 pz) e della cupola astragalica e tibia (1 pz).
In un caso fu osservata la associazione fra lesione traumatica della trocle femorale e lesione dell'LCA.
I pazienti con le lesioni traumatiche erano di età piú avanzata rispetto a quelli che soffrivano di osteocondrite
dissecante.
Cinque pz. furono precedentemente trattati chirurgicamente (microfratture, debridment artroscopico, mosai-
coplastica, perforazioni subcondrali).
I pz. furono valutati con un follow-up medio di 6.5 mesi (range 2-15).
Non furono notate complicanze.
In 6 pazienti (non trattati in precedenza e con lesione al ginocchio) furono valutati i risultati clinici e funzionali,
tramite il Lysholm function score, la scala delle attività di Tegner, la scheda ICRS ed il Cincinnati score.
Ebbene, tutti i criteri di valutazione dimostrarono un netto miglioramento dei punteggi nel follow-up.
La RMN, eseguita a 6 e 12 mesi post-intervento dimostrava invece una perfetta integrazione della neo carti-
lagine simil-jalina e una quasi totale riparazione della superficie articolare. (23).
Manfredini ha riportato una casistica di 16 pazienti.
L'età media era di 32.3 anni, con un range di 17-51.
In 12 casi sono stati osservati eccellenti risultati, 2 casi hanno fatto registrare buoni risultati e 2 pazienti hanno
riportato discreti risultati. (24).
Conclusione
Dopo trattamento con innesti osteo-condrali e con reimpianto di condrociti sono riportati in letteratura risultati
buoni; tuttavia questi risultati non sono comparabili e molti lavori specialmente con le tecniche di nuova introdu
zione riportano un follow-up breve quando occorre valutare l'evoluzione nel tempo di queste metodiche.
Allo stato attuale il problema non è risolto ma i numerosi lavori in corso lasciano ben sperare.
Possiamo perciò concludere affermando che la RMN costituisce un valido mezzo diagnostico per poter segui-
re i pz trattati con ACI.
Gli inevitabili limiti intrinseci, dovuti alla non sempre univoca interpretazione dei "messaggi" che essa ci invia,
fanno si che il chirurgo debba comunque affidarsi ad un second - look artroscopico per la certezza della bon-
tà del proprio operato.
Bibliografia
Pellacci F., Gagliardi S., Sabetta E. Risultati a distanza dell'intervento di curettage nel trattamento dell'osteocondrite
dissecante. "Il ginocchio" IX/X, 1990 Edizioni Scientifiche Cuzzolin, Napoli.
Pellacci F. , Zmerly H. "L'artroscopia del ginocchio artrosico: quale trattamento" Rivista Italiana di Biologia e Medicina,
Vol 20 ( Suppl. 3 al n. 1-2) pag. 16-21, Giugno 2000.
Peterson L, Minas T, Brittbreg M, Nilsson A, Sjogren-Jansson E, Lindhal A.: 2 to 9 year outcome after autologous
chondrocyte transplantation of the knee. Clin. Orthopaedics. 2000, 374:212-34.
Brittberg M., Lindahl A., Nilson A., Ohlsson C., Isaksson O., Peterson L. Treatment of deep cartilage defects in the
knee with autologous chondrocyte transplantation. N. Engl. J. Med., 331,889,1994.
Minas T. Autologous cultured chondrocyte implantation in the repair of focal chondral lesions of the knee: Clinical
indications and operative technique. Journal Sports Traumatology, Vol 20, n°2, 90-102, 1998.
Brittberg M., Winalski Carl. Evaluation of cartilage injuries and repair.JBJS Am.2003. Sup 2. 85-A: 58-69.
Burstein D., Gray M.. New MRI techniques for imaging cartilage. JBJS Am.2003. Sup 2. 85-A: 70-77.
Roberts S., Mc Call W., Darby A., Menage J, Evans H., Harrison P., Richerdson J. Autologous chondrocyte implanta-
tion for cartilage repair: monitoring its success by magnetic resonance imaging and histology. Arthritis
research and therapy. 2003. 5:R60-R73.
Henderson I.J.P., Tuy B, Connell D, Oakes B, Hettwer H. Prospective clinical study of autologous chondrocyte implan-
tation and correlation with MRI at 3 and 12 month. JBJS Br. 2003. 85-B :1060-66.
Laasanen M.S. e coll. Mechano-acoustic diagnosis of cartilage degeneration and repair. JBJS Am.Sup 2. 85-A: 78-84.
Robin Poole. What type of cartilge repair are we attempting to? JBJS Am. Sup 2. 85-A: 40-4.
Briggs T.W.R., Mahroof S., David L.A., Flannelly J., Pringle J., Bayliss M.. Histological evaluation of chondral defects
after auotologous implantation of the knee. JBJS Br. 2003, 85-B:1077-83.
Schneider U., Schlegel U., Bauer S., Siebert C.H.. Molecular m,arkers in the evaluation of autologous chondrocyte
implantation. Arthroscopy. 2003, 19(4): 397-403.
Mont M., Jones L., Vogelstein B.N., Hungerford D. S.. evidence of inappropriate application of autologous cartilage
transplantation therapy in an uncontrolled environment. Am. J. Sport Med.. 1999; 27 (5) : 617-620.
Navarro R., Cohen Moises, Carneiro Filho M., Texeira da Silva R.. The artrhoscopic treatment of osteochonditis
dissecans of the knee with autologous with bone sticck. Arthroscopy. 2002. 18 (8): 840-44.
Jurgennsen I., Bachman G., Schleicher I., Haas H.. Artrhroscopic versus conservaie treatment of osteochondritis
dissecans of the knee: value of Magnetic Resonance Imaging in therapy planning and follow-up.
Arthroscopy. 2003. 18 (4): 378-386.
Scaglione N., Miniaci A., Gillogly S., Carter T.. Update on advanced surgical techniques in the treatment of traumatic
focal articular cxartilage lesion in the knee. Arthroscopy. 2002. 18 (2), Sup 1: 9-32.
Peterson L,Minas T, Brittbreg M, Lindhal A.Treatment of osteochonditis dissecans of the knee with autologous
chondrocyte transplantation. JBJS Am. 2003. 85-A. Sup. 2:17-24.
Shasha N., Krywulak S., Backstein D., Pressman A., Gross A. E.. Long-term follow-up of fresh tibial osteochondral
allograft for failed tibial plateau fractures. JBJS. 2003. 85-A. Sup.2:33-39.
Marlovits S, Khanakah G, Striessnig G, Vecsei V, Stanek G. Emergence of lyme arthritis after autologous chondrocyte
transplantation.Arthritis Rheum. 2004 Jan;50(1):259-64.
Recht M., White L.M., Winalski C., Miniaci A., Minas T., Parker R.D.. MR imaging of cartilage repair procedures.
Skeletal Radiology. 2003.
Grigolo B, Roseti L., Fiorini M., De Franceschi L., Facchini A. Applicazioni dell'ingegneria tissutale: riparazione di
lesioni cartilaginee con condrociti autologhi. Reumatismo 2002; 54(4):364-71.
Cherubino P., Grassi FA., Bulgheroni P., Ronga M. Autologous chondrocyte implantation using a bilayer collagen
membrane: a preliminary report. Journal of orthopedic surgery. 2003: 11(1): 10-15.
Manfredini M. Il trapianto di condrociti autologhi nel trattamento delle lesioni cartilaginee del ginocchio.2001:
Tesi di specializzazione in Ortopedia. Università degli studi di Ferrara.
Iconografia

























Nessun commento:
Posta un commento